X423. To oznacza problemy
11 Kwietnia 2022Wśród wielu wykorzystywanych przemysłowo substancji chemicznych istnieje dość duża grupa chemikaliów stwarzających dodatkowe zagrożenie na skutek reakcji z wodą. Ich niekontrolowane uwolnienie może okazać się bardzo niebezpieczne w trakcie operowania prądami gaśniczymi. Wydzielające się w reakcji z wodą gazy mogą mieć charakter toksyczny, palny, żrący lub też posiadać charakterystykę mieszaną.
W niniejszym artykule zostaną omówione substancje wydzielające w kontakcie z wodą gazy palne należące głównie do klasy 4.3. W transporcie materiałów niebezpiecznych ich numer rozpoznawczy zagrożenia dla ciał stałych to zazwyczaj X423 (dla pierwszej grupy pakowania) lub 423 (dla drugiej i trzeciej grupy pakowania), w przypadku cieczy - odpowiednio X323 (pierwsza grupa pakowania) oraz 323 (druga i trzecia grupa pakowania). Do klasy 4.3 należą też wybrane chlorosilany zawierające w strukturze bezpośrednie wiązania Si-H i mające tendencję do wydzielania wodoru. Jak większość innych chlorosilanów będą one miały oznaczenie X338. Dla klasy 4.3 przez substancje należące do pierwszej grupy pakowania rozumie się te, które na tyle energicznie reagują z wodą, że wykazują tendencję do samorzutnego zapalenia lub też reagują z wodą w temperaturze otoczenia, wydzielając gaz palny z intensywnością co najmniej 10 dm3/min (600 dm3/h) w przeliczeniu na 1 kg materiału reagującego. Materiał drugiej grupy pakowania reaguje z wodą znacznie wolniej i nie powinien zapalić wydzielającego się gazu. W tej grupie gaz palny powstaje z intensywnością co najmniej 20 dm3/h w przeliczeniu na 1 kg materiału reagującego. W przypadku trzeciej grupy pakowania reakcja zachodzi jeszcze wolniej. Gaz palny powstaje z intensywnością co najmniej 1 dm3/h w przeliczeniu na 1 kg materiału reagującego.
Należy pamiętać, że grupa 4.3 nie obejmuje wszystkich materiałów wydzielających z wodą gazy palne. Część z nich należy do grupy 4.2 obejmującej materiały piroforyczne i samonagrzewające się.
Charakterystyka reaktywności z wodą
Metale alkaliczne - litowce
Do grupy metali alkalicznych zaliczamy lit (Li), sód (Na), potas (K), rubid (Rb) i cez (Cs). Ich reakcja z wodą przebiega według schematu:
M + H2O => MOH + 0,5H2
W wyniku ich reakcji z wodą generuje się wodór oraz powstaje silnie żrący roztwór wodorotlenku metalu. Wodór jako gaz 14,5 razy lżejszy od powietrza chętnie unosi się do góry. W przypadku litu powstający gaz nie powinien się zapalić, aczkolwiek zależy to od stopnia rozdrobnienia. Brak zapłonu lub spóźniony zapłon nie jest jednak korzystny. Wydzielający się wodór będzie tworzył strefę zagrożenia pożarowo-wybuchowego zwłaszcza w górnych częściach przestrzeni zamkniętych lub ograniczonych. Im dłużej wodór będzie się wydzielał bez ujścia lub zapłonu, tym większa strefa zagrożenia. Kolejne litowce potrafią zapalić łatwo wydzielający się gaz. Lit, sód i potas, jako lżejsze od wody, reagują na jej powierzchni. Ciepło reakcji sodu i potasu jest na tyle duże, że metal ulega stopieniu. Proces reakcyjny przyspiesza i często dochodzi do wybuchu reagującego metalu. Rubid i cez reagują wybuchowo praktycznie zawsze. Wynika to zarówno z jeszcze większej szybkości procesu, jak i faktu, że Rb i Cs toną w wodzie.
Metale alkaliczne mogą generować wodór lub nawet ulec zapłonowi w wilgotnym powietrzu. Intensywność procesu zależy od wilgotności względnej oraz stopnia rozdrobnienia metalu. W przeliczeniu na 1 kg metalu największe zagrożenie pożarowo-wybuchowe wbrew pozorom stanowi lit (tabela 1). W dodatku jego najmniejsza aktywność powoduje, że wodór zamiast ulec szybkiemu zapłonowi, gromadzi się.
W warunkach pożarowych litowce łatwo ulegają zapaleniu. Temperatura samozapłonu litu wynosi zaledwie 179oC. Temperatura pożaru litu jest zaś najwyższa spośród wszystkich litowców i może osiągnąć aż 2000oC. Lit, spalając się w powietrzu, tworzy tlenek litu (Li2O) oraz azotek litu (Li3N). Azotek litu w kontakcie z wodą wydziela pary amoniaku. Następne metale alkaliczne zapalają się jeszcze łatwiej, niemniej jednak nie tworzą azotków. Na przykład sód może zapalić się w temperaturze 120oC. Rubid i cez potrafią się zapalić w warunkach temperatury otoczenia. Sód w warunkach pożarowych tworzy tlenek sodu (Na2O) i nadtlenek sodu (Na2O2). Potas spala się do nadtlenku potasu (K2O2) i ponadtlenku potasu (KO2). Rubid i cez zachowują się podobnie, tworząc głównie ponadtlenki. Powstanie nadtlenków i ponadtlenków jest niekorzystne z punktu widzenia bezpieczeństwa pożarowego. Zarówno nadtlenki, jak i ponadtlenki w reakcji z wodą wydzielają tlen, intensyfikując pożar. Podobnie jest w przypadku produktów spalania innych otaczających materiałów. Nadtlenki i ponadtlenki reagują z powstałym w pożarze dwutlenkiem węgla (CO2), tworząc tlen, który intensyfikuje procesy spalania. Oto przykład reakcji z nadtlenkiem potasu:
K2O2 + H2O => 2KOH + 0,5O2 (przez etap rozpadu H2O2)
K2O2 + CO2 => K2CO3 + 0,5O2
Dwutlenek węgla reaguje także bezpośrednio z metalami alkalicznymi, tworząc czad.
Stop sodowo-potasowy (NaK, UN 1422)
Wykorzystywane przemysłowo, między innymi jako wymiennik ciepła, są także stopy sodu z potasem (NaK). Co ciekawe, w zależności od stosunku masowego, stop NaK może być cieczą eutektyczną o aktywności chemicznej większej niż każdy pierwiastek z osobna. Wyciek stopu NaK z dużym prawdopodobieństwem zakończy się jego zapłonem, zwłaszcza w przypadku uwolnienia na wilgotne podłoże.
Wybrane metale ziem alkalicznych
Do najczęściej spotykanych metali ziem alkalicznych zaliczamy magnez (Mg), wapń (Ca), stront (Sr) oraz bar (Ba). Nie licząc magnezu, każdy z nich dość intensywnie reaguje z wodą w warunkach normalnych, wydzielając wodór. Przy czym, podobnie jak u litowców, reaktywność wzrasta wraz ze wzrostem masy atomowej w grupie. Magnez reaguje w sposób widoczny dopiero z parą wodną lub gdy jest silnie podgrzany. Niemniej jednak sproszkowany magnez lub jego stopy (UN 1418) stanowią materiały samonagrzewające się. Dzięki temu mogą ulegać reakcji z wodą i wydzielać wodór. Ca, Sr i Ba należą do drugiej grupy pakowania i nie zapalają wydzielającego się wodoru. Stąd też gaz może się gromadzić, tworząc strefę zagrożenia pożarowo-wybuchowego. Ca, Sr i Ba tak jak litowce w reakcji z wodą tworzą silnie żrący wodorotlenek. Ponadto wodorotlenek baru oraz rozpuszczalne sole baru mają również charakter toksyczny.
 Pożar metali ziem alkalicznych generuje wysoki strumień ciepła. Najwyższą temperaturę pożaru obserwuje się w przypadku magnezu. Może ona dochodzić do 2200oC. Magnez spalając się, reaguje również z azotem atmosferycznym. Oprócz tlenku magnezu (MgO) powstaje też azotek magnezu (Mg3N2). W reakcji z wodą azotek magnezu będzie generował amoniak. Analogicznie wygląda sytuacja w przypadku wapnia. W pożarze strontu i baru oprócz tworzenia zwykłych tlenków (SrO i BaO) oraz azotków (Sr3N2, Ba3N2) możemy zaobserwować także powstawanie nadtlenków (SrO2 i BaO2). Podobnie jak nadtlenki litowców, nadtlenki baru i strontu w kontakcie z wodą i pożarowym CO2 będą wytwarzały tlen intensyfikujący procesy spalania.
Pożar metali ziem alkalicznych generuje wysoki strumień ciepła. Najwyższą temperaturę pożaru obserwuje się w przypadku magnezu. Może ona dochodzić do 2200oC. Magnez spalając się, reaguje również z azotem atmosferycznym. Oprócz tlenku magnezu (MgO) powstaje też azotek magnezu (Mg3N2). W reakcji z wodą azotek magnezu będzie generował amoniak. Analogicznie wygląda sytuacja w przypadku wapnia. W pożarze strontu i baru oprócz tworzenia zwykłych tlenków (SrO i BaO) oraz azotków (Sr3N2, Ba3N2) możemy zaobserwować także powstawanie nadtlenków (SrO2 i BaO2). Podobnie jak nadtlenki litowców, nadtlenki baru i strontu w kontakcie z wodą i pożarowym CO2 będą wytwarzały tlen intensyfikujący procesy spalania.
Wodorki metali
Podobnie jak w przypadku analizowanych metali aktywnych, wodorki metali reagują z wodą, wydzielając wodór oraz wodorotlenek. Dla wodorków litowców ogólny przykład reakcji przedstawiono poniżej:
MH + H2O => MOH + H2
Wodorki wydzielają dwukrotnie więcej wodoru na mol substancji niż same metale aktywne, od których pochodzą. W ten sposób kilogram metalicznego litu może wydzielić w warunkach normalnych 1,6 m3 wodoru, natomiast wodorek litowy - aż 2,8 m3. Powoduje to, że potencjalne zagrożenie pożarowo-wybuchowe istnieje w znacznej objętości. W tym wypadku rozkład zaledwie 1 kg wodorku litu (LiH) może powodować powstanie mieszaniny palnej, w której stężenie wodoru osiąga wartość dolnej granicy wybuchowości (DGW) w przestrzeni aż 70 m3. W dodatku znaczna liczba wodorków nie zapala wydzielającego się w reakcji z wodą wodoru tak łatwo, jak metale alkaliczne. Stąd też wydzielający się gaz będzie miał znacznie większe możliwości gromadzenia się. Niemniej jednak istnieje ryzyko zapalenia się niektórych wodorków w wilgotnym powietrzu (np. LiH, LiAlH4, NaH).
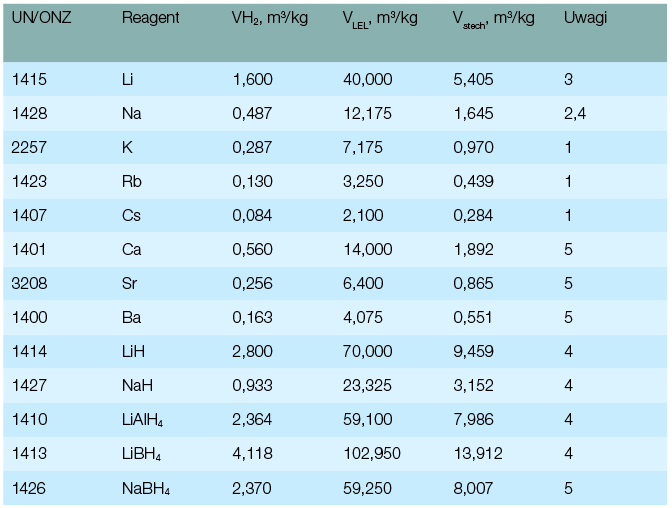 |
Oznaczenia (tabela 1.): VH2 - maksymalna objętość wodoru wydzielająca się w warunkach normalnych VLEL - maksymalna objętość, jaką może zająć mieszanina palna przy dolnej granicy wybuchowości wodoru Vschech - objętość, jaką może zająć mieszanina palna o największej sile wybuchu (przy stężeniu stechiometrycznym wodoru) 1 - zapali się w wilgotnym powietrzu lub wybuchnie w wodzie przed wydzieleniem całkowitej ilości wodoru 2 - w wodzie zapali wydzielający się wodór, ryzyko wybuchu 3 - ryzyko zapłonu w reakcji z wodą i wybuchu wodoru w przypadku jego nagromadzenia się 4 - ryzyko zapłonu w wilgotnym powietrzu 5 - materiał ciepłem reakcji nie powinien zapalić wydzielającego się wodoru |
Wodorki metali w większości wypadków ulegają zapłonowi już w nieznacznie podwyższonej temperaturze. Dlatego popularnie wykorzystywany jako środek redukcyjny glinowodorek litu (LiAlH4) zapala się w kontakcie z gorącą powierzchnią w temperaturze ok. 125-150oC. Jego zapłon może spowodować nawet wiązka wskaźnika laserowego. W pożarze wodorków w pierwszej kolejności następuje wypalenie się znajdującego się w ich strukturze wodoru. W drugim etapie następuje pożar metalu z wytworzeniem jego tlenku. To powoduje, że temperatura w drugim etapie pożaru jest bardzo wysoka, a jego gaszenie wymaga tych samych środków, które stosuje się do gaszenia pożarów metali. 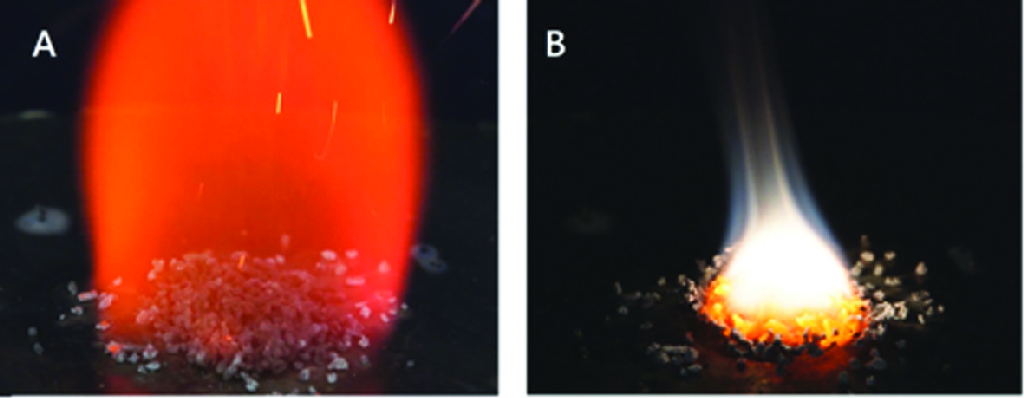
Wodorki metali zazwyczaj transportowane są w niewielkich ilościach w postaci sproszkowanej. Pył wodorków zawieszony w powietrzu jest silnie wybuchowy, co stwarza dodatkowe zagrożenie podczas uwolnienia.
Zagrożenie pożarowe związane z transportem wodorków może jeszcze wzrosnąć, gdy przewożone są w rozpuszczalniku organicznym. Do takich przypadków należy np. transport glinowodorku litu w eterze dietylowym (UN 1411). Eter dietylowy sam w sobie stanowi ciecz ekstremalnie łatwopalną, o wysokiej prężności par i szerokich granicach wybuchowości (1,85-36% objętości).
Niektóre wodorki mają silne właściwości piroforyczne - ulegają samorzutnemu zapłonowi w powietrzu w czasie nie dłuższym niż 5 min. Do takich materiałów należy np. borowodorek glinu (UN 2870) o numerze rozpoznawczym zagrożenia X333. Jest to ciecz o wysokiej lotności i temperaturze wrzenia 44,5oC, mająca w składzie aż 16,9% wagowych wodoru. Jej reakcja w wodzie i wilgotnym powietrzu może mieć przebieg wybuchowy. Ze względu na swoje zachowanie zakwalifikowany jest do klasy 4.2 materiały samozapalne.
Węgliki jonowe
Zagrożenie pożarowe w kontakcie z wodą stwarzają jedynie tzw. węgliki jonowe. Do tej grupy należą związki mające w strukturze anion ([C≡C]2−), C4− lub [C=C=C]4−, nazywane także odpowiednio acetylenkami, węglikami oraz allilkami. Do acetylenków należy popularny karbid (węglik wapnia, CaC2) oznaczony numerem UN 1402. Węglik wapnia w kontakcie z wodą wydziela intensywnie acetylen, gaz skrajnie łatwopalny o szerokich granicach wybuchowości (2,3-100%). Ilość gazu generowanego w jednostce czasu jest bardzo znaczna. Reakcja z wodą w przestrzeni ograniczonej może doprowadzić do bardzo szybkiego powstania strefy zagrożenia pożarowo-wybuchowego. Nieszczelny pojemnik po dostaniu się do niego wody może eksplodować. Szybkość procesu wydzielania acetylenu zależy od czystości węglika wapnia oraz stopnia rozdrobnienia, stąd też może być zakwalifikowany do pierwszej lub drugiej grupy pakowania. Techniczny karbid zawiera około 80-85% CaC2. W składzie może mieć między innymi fosforek wapnia (Ca3P2), azotek wapnia (Ca3N2), tlenek wapnia (CaO), siarczek wapnia (CaS) oraz węglik krzemu (SiC). Szczególnie niebezpieczne jest zanieczyszczenie fosforkiem wapniowym, który w kontakcie z wodą tworzy silnie toksyczny i także skrajnie łatwopalny fosforowodór (PH3). Obecność azotku wapniowego jest natomiast odpowiedzialna za ślady amoniaku. Teoretycznie czysty węglik wapnia może wytworzyć w reakcji z wodą 0,35 m3 acetylenu. W praktyce techniczny CaC2 wydziela go 0,295-0,3 m3/kg.
Do innych węglików wartych uwagi należy węglik (metanek) glinu (Al4C3) o numerze UN 1394. W reakcji z wodą wydziela metan (CH4). Szybkość tego procesu jest jednakże znacznie mniejsza niż w przypadku węgliku wapnia. Powstały gaz stanowi także znacznie mniejsze zagrożenie pożarowe niż acetylen. Niemniej jednak zawilgocony węglik glinu w ograniczonej przestrzeni może doprowadzić do powstania atmosfery wybuchowej.
Chlorosilany zawierające bezpośrednie wiązanie Si-H
Oprócz SiCl4 wszystkie chlorosilany są związkami łatwopalnymi, w niektórych wypadkach mogącymi zapalić się samorzutnie na powietrzu. Substancje te reagują bardzo gwałtownie z wodą, wytwarzając toksyczny i żrący chlorowodór. Stąd też najczęściej ich numer rozpoznawczy zagrożenia oznaczany jest przez X338. Jednak chlorosilany z bezpośrednim wiązaniem Si-H mają dodatkowo możliwość wydzielania wodoru w procesie hydrolizy wspomnianego wiązania, przebiegającej według ogólnego schematu poniżej:
~Si-H + H2O => ~Si-OH + H2.
Do takich związków należy m.in. etylodichlorosilan (C2H5HSiCl2), metylodichlorosilan (CH3HSiCl2) czy trichlorosilan, odpowiednio o numerach UN 1183, 1242, 1295. Chlorosilany należące do pierwszej grupy pakowania klasy 4.3, wydzielające w reakcji z wodą wodór, które nie są bezpośrednio wymienione z nazwy chemicznej w międzynarodowych umowach przewozu materiałów niebezpiecznych, mogą ukrywać się także pod numerem UN 2988.
Generowanie wodoru w trakcie reakcji z wodą znacznie zwiększa i tak bardzo duże zagrożenie palne i toksykologiczne tych substancji. W przypadku CH3SiCl2 proces reakcji jest tak szybki, że przewidziana połowa maksymalnej wydajności teoretycznej procesu hydrolizy zostaje osiągnięta po 7 sekundach.
Amidki metali alkalicznych (UN 1390) i ziem alkalicznych
Amidki stwarzają zagrożenie pożarowe poprzez swoją palność. Reagują intensywnie z wodą, wydzielając amoniak oraz żrący wodorotlenek metalu. Oto przykład reakcji:
NaNH2 + H2O => NaOH + NH3
W warunkach pożarowych reagują z sadzą, wydzielając toksyczne opary cyjanków oraz wodór. Reakcja taka wygląda następująco:
NaNH2 + C => NaCN + H2
Amidki pozostawione na powietrzu chłoną wodę z powietrza, ulegając rozkładowi z wydzieleniem amoniaku. Z czasem w powietrzu oraz podczas przechowywania, jeśli opakowania są niedostatecznie szczelne, zaczynają stanowić zagrożenie wybuchowe. Przyczyną tego jest tworzenie nadtlenków. Ze względu na wysoką energię zapłonu oraz wysoką wartość DGW powstającego amoniaku (15%) wielkość strefy zagrożenia pożarowego w przypadku amidków będzie mniejsza niż w przypadku wodorków.
Amidki metali ziem alkalicznych również reagują bardzo intensywnie z wodą, wydzielając amoniak. Związki te mają charakter piroforyczny i mogą się samorzutnie zapalić w kontakcie z powietrzem zwłaszcza wilgotnym. Przebieg reakcji może być tak szybki, że połowa teoretycznej wydajności amoniaku osiągnięta zostanie w ułamku sekundy. Przykładem może być piroforyczny dwuamidek magnezu (UN 2004) zakwalifikowany do klasy 4.2.
Fosforki
Fosforki metali alkalicznych i ziem alkalicznych reagują intensywnie z wodą, wytwarzając silnie toksyczny fosforowodór (PH3), który może ulec zapłonowi ze względu na obecność piroforycznej difosfiny (P2H4) lub też przy zbytnim nagrzaniu się próbki w toku reakcji. Fosforki zatem mogą się zapalić w wilgotnym powietrzu lub przy niewielkiej ilości wody. W przypadku zastosowania znacznego nadmiaru wody do zapłonu nie dochodzi. Rozkład fosforków zachodzi wolniej niż wodorków, azotków czy węglików. Przykładowo jeden z bardziej reaktywnych fosforków, fosforek sodu Na3P (UN 1432), przy nadmiarze wody rozkłada się z taką prędkością, że połowę teoretycznej ilości fosforowodoru otrzymuje się po około 15 min. W przewozie materiałów niebezpiecznych występuje m.in.: fosforek wapnia Ca3P2 (UN 1360), fosforek glinu AlP (UN 1397), fosforek sodu Na3P (UN 1432), fosforek cynku Zn2P3 (UN 1714), fosforek magnezu Mg3P2 (UN 2011), fosforek potasu K3P (UN 2012) i fosforek strontu Sr3P2 (UN 2013). Niektóre z fosforków stosuje się w postaci pestycydów (np. pestycyd fosforku glinu, UN 3048). Niemniej jednak w takim stanie nie stwarza on znacznego ryzyka pożarowego, a przede wszystkim zagrożenie toksykologiczne.
Krzemki metali
Ciekawą grupę stanowią krzemki metali alkalicznych i ziem alkalicznych. Związki te należą do drugiej i trzeciej grupy pakowania. W reakcji z wodą wytwarzają wodór, jednakże reakcja ta jest znacznie wolniejsza niż np. w przypadku wodorków czy węglików. Krzemki metali mogą się zapalić w kontakcie z wilgotnym powietrzem. Przykład reakcji krzemków z wodą podano na przykładzie NaSi:
2NaSi + 5 H2O => Na2Si2O5 + 5H2
W transporcie materiałów niebezpiecznych obecny jest między innymi krzemek wapnia
(UN 1405), krzemek litu (UN 1417), krzemek magnezu (UN 2624) żelazokrzemek litu
(UN 2830), krzemek manganu i wapnia (UN 2844).
Gaszenie i neutralizacja
.jpg?1657101551122) Gaszenie pożarów metali oraz wodorków metali wymaga szczególnych warunków. Przede wszystkim musi to być suchy, niereagujący materiał o stosunkowo wysokiej temperaturze topnienia. Do gaszenia tych pożarów nie można wykorzystywać wody ani środków pianotwórczych, ze względu na intensyfikację pożaru. Nie wchodzi także w grę stosowanie gazów gaśniczych. CO2 rozkłada tworzące się w procesie spalania nadtlenki metali z wytworzeniem tlenu intensyfikującego ten proces. Inną kwestią jest egzotermiczna redukcja CO2 do CO. Zastosowanie azotu nie daje dobrego skutku ze względu na brak możliwości odcięcia dopływu utleniacza. Dodatkowo lit oraz metale ziem alkalicznych reagują z azotem. W grę nie wchodzą też związki halogenoorganiczne, niezależnie, czy będą to niedopuszczone halony, czy też ich zamienniki. Wysoka temperatura pożaru doprowadzi do ich natychmiastowego rozkładu. W przypadku cieczy halogenoorganicznych oprócz rozkładu termicznego następuje ich nagłe przejście fazowe i wybuch.
Gaszenie pożarów metali oraz wodorków metali wymaga szczególnych warunków. Przede wszystkim musi to być suchy, niereagujący materiał o stosunkowo wysokiej temperaturze topnienia. Do gaszenia tych pożarów nie można wykorzystywać wody ani środków pianotwórczych, ze względu na intensyfikację pożaru. Nie wchodzi także w grę stosowanie gazów gaśniczych. CO2 rozkłada tworzące się w procesie spalania nadtlenki metali z wytworzeniem tlenu intensyfikującego ten proces. Inną kwestią jest egzotermiczna redukcja CO2 do CO. Zastosowanie azotu nie daje dobrego skutku ze względu na brak możliwości odcięcia dopływu utleniacza. Dodatkowo lit oraz metale ziem alkalicznych reagują z azotem. W grę nie wchodzą też związki halogenoorganiczne, niezależnie, czy będą to niedopuszczone halony, czy też ich zamienniki. Wysoka temperatura pożaru doprowadzi do ich natychmiastowego rozkładu. W przypadku cieczy halogenoorganicznych oprócz rozkładu termicznego następuje ich nagłe przejście fazowe i wybuch.
Do gaszenia metali nie można także zastosować proszków gaśniczych ABC ani BC. Proszek ABC nie jest w stanie stworzyć szczelnej powłoki ze względu na zbyt niską temperaturę rozkładu wodorofosforanów. Dodatkowo obecność kwasowego wodoru może intensyfikować reakcje płonącego metalu. W przypadku proszku BC następuje jego rozkład termiczny do CO2 i jego dalsza egzotermiczna reakcja. Słuszne będą jedynie środki przeznaczone do gaszenia pożarów grupy D, np. chlorek sodu (NaCl). Innym rozwiązaniem może być suchy piasek. Wysoka temperatura pożaru metalu nadtapia te substancje, ale nie powoduje ich wrzenia. Z tego powodu może wytworzyć się szczelna warstwa uniemożliwiająca dopływ utleniacza.
W przypadku niekontrolowanego uwolnienia się dużej ilości silanów polecane jest stosowanie piany alkoholoodpornej o wysokim stopniu napowietrzenia. Zabezpieczy to rozlewisko przed jego zniszczeniem i dodatkowo zminimalizuje reaktywność chlorosilanów względem wody. Dlatego najlepiej sprawdza się piana wytworzona przez agregaty CAFS. W przypadku analizowanych silanów zawierających wiązania Si-H należy pamiętać, że w strukturze piany mogą być uwięzione znaczące ilości wodoru stwarzające zagrożenie pożarowo-wybuchowe. Pianę poleca się podawać bardzo delikatnie, najlepiej nie bezpośrednio na rozlewisko a przez odbicie jej strumienia od elementów stałych.
Neutralizację resztek metali alkalicznych i ziem alkalicznych, takich jak Li, Na, K, Ca, Sr, Ba, wodorków metali, węglików, amidków i fosforków powinno się przeprowadzić w przestrzeni otwartej, z dala od źródeł zapłonu. Do tego celu należy wykorzystać metalowe wiadro, które jest łatwo uziemić. Do wiadra dodaje się tyle roztworu wodorowęglanu sodu (roztworu sody oczyszczonej), aby było wypełnione w całości. W wiadrze nie powinno być wolnej przestrzeni do gromadzenia się gazu. To pozwoli na rozproszenie powstającego gazu nad wiadrem lub też jego kontrolowane wypalenie się, gdy reagująca substancja zapali wydzielający się gaz palny.
Pod wiadrem powinien znajdować się pojemnik o większej średnicy, do którego może ewentualnie spływać wychlapująca się ciecz - zadziała on podobnie jak taca bezpieczeństwa.
Do tak przygotowanego zestawu należy dodawać małymi kilkugramowymi porcjami neutralizowane związki. Dodawanie kolejnej porcji powinno następować po przereagowaniu poprzedniej. Przereagowanie będzie można obserwować na podstawie pęcherzyków wydzielającego się gazu.
Powstające w procesie rozkładu z wodą wodorotlenki ulegną neutralizacji w reakcji z wodorowęglanem sodu. Aby łatwo przygotowywać roztwory umiarkowanie rozpuszczalnego NaHCO3, proponuje się, aby roztwór węglanu miał stężenie około 5%.
Dla przykładu wodorotlenek sodu powstający w reakcji z wodą, np. metalicznego sodu, wodorku sodu, fosforku sodu czy też amidku sodu, będzie reagował z wodorowęglanem w następujący sposób:
NaOH + NaHCO3 => Na2CO3 + H2O
W przypadku większych zdarzeń wodorotlenki powstałe w sposób niekontrolowany po przereagowaniu z prądami wody ulegną procesowi neutralizacji z CO2 zawartym w powietrzu. Do doczyszczania powierzchni poprzez sorbowanie warto wykorzystać sorbenty hydrofilowe, np. sorbenty kalcynowane.
W przypadku krzemków neutralizację można przeprowadzić za pomocą samej wody.
Resztki cezu i rubidu bardzo szybko przechodzą w nadtlenki, ponadtlenki, wodorotlenki oraz węglany już po niewielkim rozszczelnieniu pojemnika. Stąd też warto te próbki pozostawić na działanie powietrza. Przebieg reakcji Cs i Rb z wodą jest niekontrolowany i praktycznie zawsze kończy się wybuchem, co stanowi zagrożenie rażenia odłamkami szkła. Ze względu na swoją wysoką aktywność metale te przewożone są w hermetycznych pojemnikach szklanych wypełnionych gazem szlachetnym.
Do neutralizacji resztek chlorosilanów warto wykorzystać także roztwory wodorowęglanu sodowego w nadmiarze. Reakcję neutralizacji można obserwować poprzez wydzielanie się pęcherzyków CO2 powstających w reakcji z HCl tworzącego się z rozkładu chlorosilanów.
kpt dr Tomasz Węsierski pełni służbę w Instytucie Inżynierii Bezpieczeństwa SGSP
Literatura dostępna u autora
st. kpt. dr Tomasz Węsierski pełni służbę w Instytucie Inżynierii Bezpieczeństwa SGSP
