Neutralizatory w ratownictwie chemicznym
15 Marca 2022Wzrost ilości przewożonych, magazynowanych oraz przetwarzanych substancji chemicznych zwiększa z roku na rok ryzyko ich niekontrolowanego uwolnienia. Jedną z metod ograniczających rozprzestrzenianie się zagrożenia jest wykorzystanie neutralizatorów chemicznych.
Cel ich użycia wydaje się zrozumiały. Przez neutralizację substancja agresywna traci swoje właściwości niebezpieczne. W działaniach ratowniczych usuwanie rozlewisk cieczy niebezpiecznych często skupia się na sorbowaniu lub rozcieńczaniu. Nie zawsze jednak da się dokładnie zebrać substancję i doczyścić miejsce zdarzenia.
Problematyczne substancje
W niektórych sytuacjach wykorzystanie sorbentu może okazać się niebezpieczne. Jest grupa substancji chemicznych, które wymagają przeznaczonych specjalnie do nich sorbentów. Przykładowo kwas fluorowodorowy (HF) będzie rozpuszczał wszelkie sorbenty mające w swojej strukturze krzemionkę (SiO2), wytwarzając przy tym toksyczny czterofluorek krzemu (SiF4). Dlatego odpadają nam bardzo popularne sorbenty mineralne, które najczęściej kojarzymy z lubianą przez ratowników formą kalcynowanych granulatów.
Innym przykładem są pochodne tlenku etylenu, np. tlenek propylenu, epichlorohydryna czy tlenek styrenu. W ich przypadku zastosowanie sorbentów diatomitowych prowadzi do egzotermicznej reakcji polimeryzacji z ryzykiem zapłonu. Rozcieńczanie natomiast często odbywa się ze szkodą dla środowiska. Aby rozcieńczyć 1 l czystego kwasu siarkowego (H2SO4) do w miarę bezpiecznego pH (przyjmijmy pH = 5), potrzebne byłoby około 3800 m3 wody.
Są też takie substancje, których skutków uwolnienia nie usuniemy przez sorbowanie ani przez rozcieńczanie. Należą do nich substancje o odrażającym zapachu. W tym gronie możemy znaleźć łatwo dostępny i popularny kwas masłowy czy też tiole i siarczki organiczne. Usunięcie nawet niewielkich ilości tych związków stanowi poważny problem. Stąd też kiedy nie jesteśmy w stanie zebrać bezpiecznie i skutecznie uwolnionej substancji, warto pomyśleć o bezpiecznym, a zarazem ekonomicznym procesie neutralizacji.
Najlepszy neutralizator
Idealny neutralizator ma być tani i łatwo dostępny, ponadto stabilny chemicznie i nie ulegać starzeniu. Jego przechowywanie nie powinno nastręczać problemów. Ważne, by przygotowanie i użycie go było bezpieczne dla ratowników. Nadmiarowa dawka neutralizatora nie może być szkodliwa dla środowiska.
W kwestii neutralizacji kwasów warto zwrócić uwagę na trzy grupy związków. Należą do nich wodorotlenki, tlenki oraz węglany metali alkalicznych oraz ziem alkalicznych. Najtańsze i zarazem najłatwiej dostępne to:
- CaO - tlenek wapnia, zwany inaczej wapnem palonym,
- Ca(OH)2 - wodorotlenek wapnia, jest składnikiem wapna hydratyzowanego,
- NaOH - wodorotlenek sodowy (soda kaustyczna),
- NaHCO3 - kwaśny węglan sodowy (wodorowęglan sodu) - główny składnik sody oczyszczonej,
- Na2CO3 - węglan sodowy, soda kalcynowana,
- CaCO3 - węglan wapnia, główny składnik kredy,
- CaCO3.MgCO3 - mieszanina węglanu wapnia i węglanu magnezu, wchodzi w skład dolomitu.
Znacznie droższym rozwiązaniem jest tlenek magnezu (MgO). Ma on jednak wiele zalet, które także zostaną omówione. W działaniach neutralizacyjnych wykorzystywany jest również preparat UNI-SAFE o charakterze sorbentu neutralizatora.
W przypadku neutralizacji związków o charakterze zasadowym warto zwrócić uwagę na kwas borowy (H3BO3) czy też kwas cytrynowy (C3H4(OH)(COOH)3). W przypadku mocnych zasad do neutralizacji da się także wykorzystać wodorowęglan sodu, mający w strukturze niezneutralizowany atom wodoru.
Neutralizację halogenów (np. chloru rozpuszczonego w wodzie, bromu) można natomiast przeprowadzić za pomocą roztworów wodorotlenków oraz węglanów rozpuszczalnych w wodzie (np. NaHCO3, Na2CO3).
W niektórych przypadkach użycie środków alkalicznych może okazać się niebezpieczne. Na przykład związki zawierające co najmniej dwa atomy halogenów przy jednym atomie węgla, takie jak np. chloroform, mogą wydzielać w kontakcie z wodorotlenkami pewne ilości toksycznego fosgenu (COCl2). O ile roztwory o charakterze zasadowym zneutralizują wydzielający się fosgen o tyle stały neutralizator go nie pochłonie.
Wady i zalety wybranych neutralizatorów
CaO i Ca(OH)2 - tlenek oraz wodorotlenek wapnia
Niewątpliwą zaletą tlenku wapnia jest jego bardzo duża dostępność i cena. W postaci wapna palonego można go zakupić w każdym sklepie budowlanym. Jeśli chcemy zakupić wodorotlenek wapnia, warto kupić wapno hydratyzowane. Jeżeli otworzymy worek z wapnem, musimy go zużyć do końca. CaO jest silnie higroskopijny, chłonie wodę, a następnie dwutlenek węgla (CO2), przechodząc w węglan wapnia. Taki tlenek ulegnie zbryleniu, co utrudnia jego użycie. Podobnie przedstawia się sytuacja z zamkniętymi workami, które nie są długo wykorzystywane. Przekształcony w węglan CaO ma także znacznie niższą aktywność chemiczną. Zbryleniu ulegną też worki wapna hydratyzowanego.
Użycie tlenku wapnia wymaga często przygotowania zawiesin wodorotlenku wapnia, co nazywane jest procesem gaszenia wapna palonego. Należy pamiętać, że taki proces jest silnie egzotermiczny, co wiąże się z wydzieleniem dużej ilości ciepła.
Podczas przygotowywania zawiesin wapna gaszonego może dość do rozbryzgiwania materiału. Także sam proces neutralizacji przebiega z wydzieleniem znacznej ilości energii zarówno z CaO, jak i Ca(OH)2. Tyczy się to przede wszystkim reakcji stężonych nieorganicznych kwasów tlenowych, takich jak kwas siarkowy (H2SO4), kwas azotowy (HNO3), kwas nadchlorowy (HClO4) czy kwas ortofosforowy (H3PO4).
Ilość ciepła wydzielonego podczas neutralizacji może być tak znaczna, że dojdzie do wrzenia roztworu i powstania znacznej ilości pary utrudniającej widzialność, co jest szczególnie uciążliwe w czasie pracy w chemicznym ubraniu gazoszczelnym (CUG). Wapno palone i hydratyzowane nadaje się nie tylko do neutralizacji kwasów (w tym np. wspomnianego wcześniej kwasu masłowego), ale też do neutralizacji halogenów (np. chloru rozpuszczonego w wodzie czy bromu).
Warto wspomnieć, że zarówno CaO, jak i Ca(OH)2 są żrące. Związki te dość łatwo uszkadzają tkanki skóry w kontakcie z wodą. Użycie zbyt dużej ilości neutralizatora w postaci CaO lub Ca(OH)2 nie stanowi długotrwałego problemu dla środowiska. Tak jak wspomniałem, obydwa związki przechodzą w węglan wapnia, który jest całkowicie bezpieczny dla otoczenia.
NaOH - wodorotlenek sodowy
Wodorotlenek sodowy także należy do tanich i łatwo dostępnych odczynników. Charakteryzuje się bardzo dużą prędkością procesów neutralizacji. Niestety ma też parę utrudniających jego wykorzystanie wad. Jedną z nich jest nietrwałość podczas przechowywania. NaOH jest silnie higroskopijny i podobnie jak tlenek i wodorotlenek wapnia łatwo przechodzi w węglan. Jednakże w przypadku NaOH proces ten jest bardziej intensywny.
Pastylki wodorotlenku, chłonąc wodę z powietrza, w ciągu parunastu minut stają się śliskie. Następnie, chłonąc z powietrza CO2, ulegają zbryleniu. Wodorotlenek sodowy dostępny w handlu dostarcza się w pojemnikach plastikowych. Po zbryleniu jest praktycznie niemożliwy do wyciągnięcia z nich, stąd też ważne, aby przechowywać go w szczelnie zamkniętych pojemnikach.
NaOH powoduje ryzyko poparzeń termicznych podczas przygotowywania roztworów neutralizacyjnych. Wysokie ciepło rozpuszczania (1,1 kJ/g) może spowodować zagotowanie się roztworu oraz jego rozbryzgiwanie. Jeszcze bardziej niebezpieczny jest sam proces neutralizacji. Użycie stałego wodorotlenku przy neutralizacji stężonych kwasów spowoduje rozbryzg gorącej cieczy i powstanie bardzo dużej ilości pary. Na przykład neutralizacja stężonego H2SO4 może spowodować miejscowy wzrostu temperatury do ok. 300°C, generując natychmiast znaczne ilości pary wodnej oraz par kwasu siarkowego. Jest to reakcja tak silnie egzotermiczna, że nawet przy stosunku masowym NaOH:H2SO4 wynoszącym 1:10 temperatura wzrasta do około 140°C (rys. 1).
Podobny proces zaobserwujemy w przypadku innych popularnych kwasów. Neutralizacja zaledwie 1 dm3 36% HCl stałym wodorotlenkiem może wygenerować powstanie ok. 300 dm3 pary wodnej, ograniczającej pole widzenia ratowników. Stąd też ważne jest, aby prowadząc proces neutralizacji z wykorzystaniem NaOH, przygotować roztwory.
Przygotowanie 20% roztworu NaOH do neutralizacji wspomnianego wcześniej 36% HCl spowodowałoby wzrost temperatury roztworu jedynie o około 40°C. Wynika to z większej ilości roztworu rozpraszającej ciepło oraz z braku etapu egzotermicznego procesu hydratacji NaOH. W przypadku neutralizacji HCl, HBr, HJ i HF, będących przecież roztworami wodnymi tych gazów, dochodzi także aspekt desorpcji. Znaczny wzrost temperatury roztworu podczas procesu spowoduje znaczny spadek rozpuszczalności gazów w wodzie i ich uwolnienie z roztworu do atmosfery.
Roztwory wodorotlenku sodowego, podobnie jak poprzednio omawiany Ca(OH)2, doskonale nadają się do procesu neutralizacji halogenów. NaOH ma także pewną ważną zaletę z punktu widzenia ochrony środowiska. W przypadku zastosowania zbyt dużej ilości NaOH jego nadmiar ulega łatwo przekształceniu do bezpiecznego węglanu sodowego na skutek reakcji z CO2 z powietrza.
NaHCO3 - kwaśny węglan sodowy (wodorowęglan sodowy)
Kwaśny węglan sodowy należy również do stosunkowo tanich i łatwo dostępnych neutralizatorów. Najłatwiej zakupić go w postaci tzw. sody oczyszczonej. NaHCO3 jest znacznie trwalszy w przechowywaniu i nie ulega szybkiemu zbryleniu. Prędkość procesu neutralizacji jest mniejsza niż w przypadku CaO, Ca(OH)2 i NaOH.
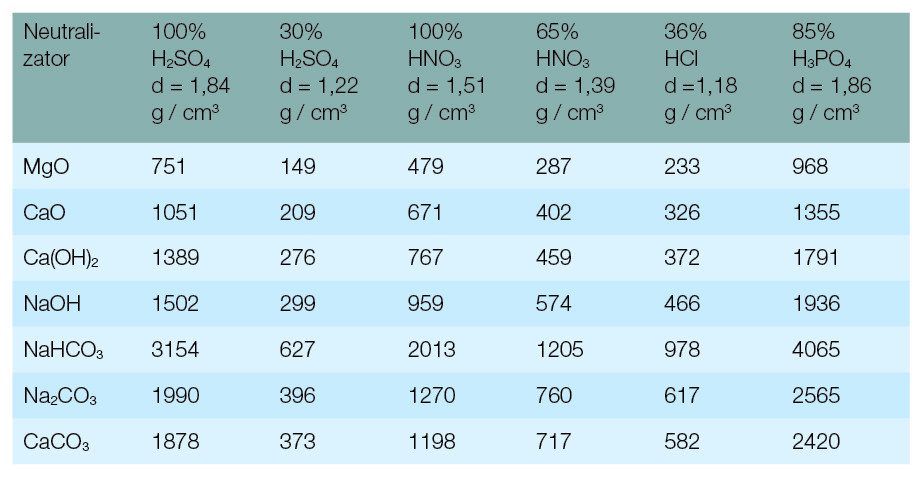
Do neutralizacji jednostkowej ilości kwasu trzeba też wykorzystać stosunkowo dużo neutralizatora (tabela 1). Łatwo pokazać to na przykładzie neutralizacji 1 dm3 czystego H2SO4 o gęstości 1,84 kg/dm3. Potrzeba tu 3,15 kg NaHCO3, ale już tylko 1,5 kg NaOH czy 1,05 kg CaO.
Zaleta jego stosowania to bezpieczeństwo. NaHCO3 nie jest żrący, a przygotowywanie jego roztworów nie wiąże się z ryzykiem wystąpienia niebezpiecznych reakcji egzotermicznych. NaHCO3 rozpuszcza się jednak w wodzie znacznie słabiej niż NaOH czy Na2CO3, co powoduje, że możemy otrzymać roztwory maksymalnie około 9%. Do neutralizacji rozlewisk kwasów można go stosunkowo bezpiecznie stosować w postaci stałej. Wydziela się dużo ciepła, lecz znacznie mniej niż podczas wykorzystania NaOH, CaO czy Ca(OH)2. Podczas reakcji chemicznej z kwasami wydziela CO2, powodując intensywne pienienie. Dzięki temu możemy zobaczyć, czy proces neutralizacji dobiegł końca, czy też należy dodać następną porcję neutralizatora.
Kwaśny węglan sodowy wykorzystuje się także w procesie neutralizacji roztworów wodorotlenków. Na przykład nadmiar NaOH można zneutralizować wodorowęglanem sodowym (NaHCO3), który sprowadza go do postaci węglanu sodowego (Na2CO3). Roztwór NaHCO3 neutralizuje halogeny (Br2, roztwory wodne Cl2). Proces ten jest jednak znacznie mniej wydajny niż przy użyciu NaOH lub wody wapiennej. Należy zastosować także dwu-, trzykrotny nadmiar w stosunku do obliczonej stechiometrycznie reakcji. Użycie neutralizatora w nadmiarze nie stanowi zagrożenia. NaHCO3 jest bezpieczny dla środowiska.
Na2CO3 - węglan sodowy (soda kalcynowana)
Węglan sodowy jest tani i łatwo dostępny w formie sody kalcynowanej. W postaci bezwodnej jest higroskopijny, a przechowywany w nieszczelnym pojemniku ulega zbryleniu. Jego reaktywność chemiczna jest większa niż w przypadku NaHCO3. Wymaga też użycia mniejszej ilości tego neutralizatora. Przygotowywanie roztworów jest znacznie łatwiejsze, gdyż Na2CO3 ma wyraźnie wyższą rozpuszczalność niż wodorowęglan. Podobnie jak w przypadku wodorowęglanów, w procesie neutralizacji kwasów wydziela się CO2, powodując intensywne pienienie. Efekty cieplne neutralizacji są wyższe niż dla wodorowęglanu sodowego, lecz znacznie mniejsze niż dla CaO, Ca(OH)2 czy NaOH.
Roztwór Na2CO3 ma charakter wyraźnie alkaliczny. W kontakcie ze skórą jest śliski i w przeciwieństwie do bezpiecznego NaHCO3 słabo żrący. Węglanu sodowego nie da się wykorzystać w procesie neutralizacji roztworów wodorotlenków. Proces neutralizacji halogenów jest efektywniejszy niż z wykorzystaniem wodorowęglanu, jednakże również wymaga zastosowania ilości odczynnika nieco ponad wartość wyliczoną teoretycznie. Użycie neutralizatora w nadmiarze nie wiąże się z ryzykiem. Na2CO3 nie stanowi dużego zagrożenia dla środowiska.
CaCO3, węglan wapnia (kreda)
Podobne jak poprzednie neutralizatory węglan wapnia jest tani i łatwo dostępny. Najłatwiej pozyskać go w postaci kredy. Kredę można nabyć jako dodatek do pasz zwierzęcych w atrakcyjnej cenie (jako kredę pastewną zawierającą min. 94% CaCO3). Kreda jest związkiem nierozpuszczalnym w wodzie, zatem w działaniach ratowniczych możemy ją wykorzystać jedynie w postaci stałej.
Proces reakcji zachodzi najwolniej ze wszystkich wspomnianych wyżej neutralizatorów. Stąd też aby przyspieszyć nieco reakcję, warto rozlewisko kwasu zrosić delikatnie prądem rozproszonym. To szczególnie ważne przy stężonych kwasach organicznych, takich jak kwas mrówkowy, octowy czy masłowy. Bez obecności wody proces ten zachodzi bardzo wolno.
Należy przy tym pamiętać, by robić to ostrożnie w przypadku stężonych nieorganicznych kwasów utleniających. Kwas siarkowy (H2SO4) czy kwas azotowy (HNO3) wydziela znaczne ilości ciepła podczas mieszania się z wodą. W sytuacjach ekstremalnych może dojść do wrzenia i rozbryzgiwania kropel wrzącej wody porywającej kwas.
Kreda, podobnie jak inne węglany, w kontakcie z kwasami wydziela CO2. To pozwala łatwo zaobserwować, czy proces neutralizacji zaszedł do końca czy też wymaga dodania neutralizatora. Ze względu na brak rozpuszczalności w wodzie kreda nie nadaje się do neutralizacji halogenów. Zastosowanie nadmiaru kredy nie stanowi zagrożenia dla środowiska.
CaCO3*MgCO3 - węglan wapniowo-magnezowy, dolomit
Węglan wapniowo-magnezowy ma bardzo zbliżone parametry do kredy. Cechuje go nieznacznie większa masowa wydajność procesu neutralizacji niż w przypadku kredy.
MgO - tlenek magnezu
Tlenek magnezu to bardzo wydajny neutralizator. Do neutralizacji trzeba go zużyć np. dwukrotnie mniej niż NaOH lub czterokrotnie mniej niż NaHCO3. W przeciwieństwie do CaO jest zdecydowanie mniej higroskopijny, co ułatwia jego przechowywanie. Nie jest żrący ani drażniący dla skóry. W wodzie - praktycznie nierozpuszczalny. Jego reakcja z wodą przebiega bardzo wolno, a powstały wodorotlenek jest zdecydowanie słabszą zasadą niż wodorotlenek wapnia. Proces neutralizacji z wykorzystaniem tlenku magnezu wydziela znacznie mniej ciepła niż z użyciem CaO, Ca(OH)2 i NaOH.
Istnieją preparaty bazujące na nanokrystalicznym tlenku magnezu. W mieszaninie z tlenkiem tytanu mają bardzo dużą powierzchnię chłonną i neutralizującą nie tylko substancje kwaśne, ale też m.in. związki siarkoorganiczne czy gazy bojowe.
Rozwiązanie jest dostępne między innymi w postaci tzw. gaśnic dekontaminacyjnych produkowanych przez firmę FastAct, będącej właścicielem technologii o tej samej nazwie. Gaśnicy dekontaminacyjnej używa się tak jak zwyczajnej gaśnicy. Umożliwia ona między innymi autodekontaminację, wypełnianie przestrzeni skażonych, sorpcję par kwaśnych. Ze względu na wysoką cenę jej wykorzystanie proponuje się w sytuacji niezwykle niebezpiecznych substancji lub też konieczności szybkiej autodekontaminacji.
MgO w postaci nanokrystalicznej dostępny w pojemnikach należy przechowywać bardzo szczelnie. Duża powierzchnia chłonna znacznie zwiększa higroskopijność i zmniejsza aktywność preparatu.
H3BO3 - kwas borowy
Kwas borowy jest dostępny w handlu w niewygórowanej cenie. To substancja stała, umiarkowanie słabo rozpuszczalna w zimnej wodzie. Jego słaba rozpuszczalność powoduje, że można z niego otrzymać w temperaturze 20°C roztwory o maksymalnym stężeniu roboczym około 5%.
H3BO3 jest kwasem bardzo słabym i słabo żrącym, o niewielkiej szkodliwości. Powoduje to, że można go stosunkowo bezpiecznie wykorzystywać w działaniach neutralizujących. Nadaje się szczególnie do neutralizacji roztworów silnie alkalicznych. Wydajność masowa procesu neutralizacji z wykorzystaniem kwasu borowego jest bardzo dobra. Wynika to z jego niskiej masy molowej i obecności trzech atomów wodoru. Za pomocą 1 kg H3BO3 można zneutralizować ponad 1,9 kg wodorotlenku sodowego.
C3H4(OH)(COOH)3 - kwas cytrynowy
Kwas cytrynowy to stosunkowo tani i bezpieczny w stosowaniu związek organiczny. W sprzedaży ten dostępny jest najczęściej pod postacią monohydratu, więc przy obliczeniach wydajności procesu neutralizacji należy uwzględnić obecność jednej cząsteczki wody i liczyć masę molową dla C3H4(OH)(COOH)3.H2O. Kwas cytrynowy ma aktywne trzy grupy karboksylowe biorące udział w procesie neutralizacji. Nadaje się do unieszkodliwiania roztworów zasadowych.
Ze względu na większą moc kwasu cytrynowego proces neutralizacji będzie przebiegał szybciej niż w obecności kwasu borowego, wydajność masowa procesu będzie jednak mniejsza. Za pomocą 1 kg kwasu monohydratu kwasu cytrynowego możemy zneutralizować około 0,57 kg NaOH, a więc ponadtrzykrotnie mniej niż za pomocą kwasu borowego.
Kwas cytrynowy rozpuszcza się w wodzie znacznie lepiej niż kwas borowy. W temperaturze 20°C w 1 dm3 wody możemy rozpuścić aż 1,6 kg, co powoduje, że roztwory da się przygotować znacznie łatwiej i w szerszym zakresie stężeń.
UNI-SAFE
Bardzo ciekawym neutralizatorem i zarazem sorbentem jest UNI-SAFE, który w kontakcie z zasadami wybarwia się na czerwono, a z kwasami na żółto. Producent zaświadcza, że produkt potrafi chłonąć 75 razy tyle, ile sam waży. Jednak należy zaznaczyć, że podwyższona chłonność dotyczy wody oraz roztworów wodnych!
Chłonność substancji organicznych jest wyraźnie mniejsza. Zwiększa się ona przy delikatnym zwilżeniu neutralizatora prądem rozproszonym, jednak nie będzie ona wynosiła więcej niż 3-4 kg na kg UNI-SAFE. Tyczy się to substancji niepolarnych typu benzyna, olej napędowy czy rozlewiska węglowodorów aromatycznych. W przypadku rozlewisk alkoholi niskocząsteczkowych (np. metanolu) nie zauważa się wzrostu chłonności podczas aktywacji wodą i może wynieść ona mniej niż chłonność popularnych sorbentów mineralnych.
Podsumowanie ogólnych właściwości omawianych neutralizatorów
Egzotermiczność procesu, ryzyko wrzenia i rozchlapywania podczas neutralizacji kwasów:
NaOH > Ca(OH)2 > CaO > Na2CO3 > NaHCO3 > CaCO3
Wydajność masowa procesu neutralizacji kwasów: CaO > Ca(OH)2 > NaOH > CaCO3 > Na2CO3 > NaHCO3
Wydajność masowa procesu neutralizacji halogenów:
Ca(OH)2 > NaOH > Na2CO3 > NaHCO3
Szybkość procesu neutralizacji halogenów:
NaOH > Ca(OH)2 > Na2CO3 > NaHCO3
Literatura
- T. Węsierski, M. Majder-Łopatka, A. Walczak, Restrictions on the use of specimen based on magnesium and titanium nanocrystalline oxides in incidents involving uncontrolled release of hazardous substances, Applied Sciences 2020, 10: 267.
- https://fast-act.com/fast-act-technology/.
st. kpt. dr Tomasz Węsierski pełni służbę w Instytucie Inżynierii Bezpieczeństwa SGSP


